国家药监总局3月9日发布《化学
药品注册分类改革工作方案的公告》,本文通过
国务院同意,这表明药品注册分类工作已推向国家战略高度。
此次全新的注册分类办法从六类缩减成五类,更让人关注的是,“临床疗效”的概念更加强烈,“改良型新药要求比改良前具有明显的临床优势”、"仿制药与原研药品质量和疗效一致"的字眼在《公告》中更加明显,这也就意味着治疗效果将成为检验新药质量最重要的指标。
该《公告》的出台,预示着我国药品注册工作的又一个里程碑,而对于制药行业来说,在苦苦挣扎了半年许久之后,药品注册申请工作又能"有法可依"而继续进行。那么,新版药品注册分类改革将会产业带来哪些变化呢?
重启药品注册工作
自从去年药品7月22日,药监部门开始临床试验自查、核查,不仅仅改变了研发生态、药品竞争格局、新品上市节奏。
《公告》的出台解决了药品注册申报资料的方向问题,明确了自己的资料需要什么,如不满足要求该如何补充资料,让注册资料的撰写工作重新启动起来,注册工作得以继续运转。
但对于对中小企业来讲,更是挑战。他们如果没有创新能力与资金来源,要尽早谋求兼并。有分析人士指出,转行也是企业可以考虑的,利用现有的条件和设备做化工品等。而大企业则应该继续走新药研发的道路,以占据一定的市场地位。
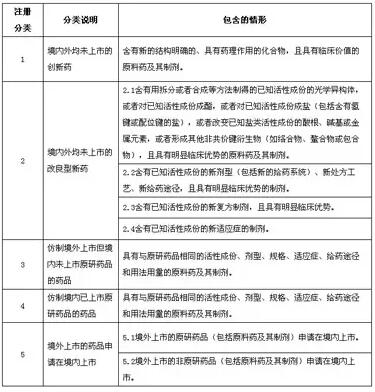
(图为化学药品新注册分类、说明及包含的情形)
与全球逐渐接轨
境内外均未上市的创新药可进行申报是此次注册分类的最大看点。
众所周知,我国的药品分类注册办法一直相对于保守,普遍是在经历过欧美药监部门审批之后,才能在中国进行申报,大大延缓了专利药的上市时间。
而这一条目的修改将使中国享受到重磅药物全球同步上市的政策红利,这对中国药品开发和质量提升,以及新药的研发有很好的促进作用。但具体如何申报注册,业内还存有疑问。
国内的制药企业今后在研发新药时,首先要考虑临床需求,其次是药物在上市后是否还有改进的空间。有分析人士指出,我们对手已不局限于国内市场了,与全球发达国家接轨已实在必行。
药品上市许可人
"药品上市许可人制度"是将上市许可与生产许可实行分离管理的制度模式,使得药品上市许可与生产企业不再捆绑,美国、欧盟各国以及日本等国家均实行该制度,而我国,目前已经开始了试点工作。
新的化药分类,是上市许可持有人制度及新药审批改革中重要的一环,"上市许可人"作为药品研发的责任主体需与药品注册要求相协调,只有将上市许可与注册分类规定的明确之后,方能为更为细致的政策和概念的出台打下基础。
《公告》中对不同类型的药品相对应的上市许可人的任务进行了划分,这样更有利于"许可人"的研发方向。